QU’EST-CE QUE LA DOCUMENTATION 3T ?
Dans la chaîne d’approvisionnement pharmaceutique, tous les partenaires commerciaux sont agréés soit par la FDA, soit par le State Board of Pharmacy. Les membres de la chaîne d’approvisionnement ne peuvent acheter ou vendre des produits qu’aux parties disposant d’une licence active.
Cela signifie concrètement que chaque partenaire de la chaîne d’approvisionnement évalue régulièrement les licences de ses clients et fournisseurs.
Outre les licences, le vendeur doit fournir des documents de transaction standardisés à ses clients pour chaque expédition. Ces documents comprennent :
LES INFORMATIONS TRANSACTIONNELLES (IT)
Ce document décrit les spécificités de la transaction en cours. Cela comprend :
- Le nom du produit
- Le dosage et la force du produit
- Le NDC (code national du médicament)
- Le numéro de lot
- La date de transaction
- La date d’expédition
- Les informations sur les conteneurs
- Le nombre de conteneurs
Si plus de 24 heures se sont écoulées depuis la date de la transaction, la date d’expédition doit être incluse.
L’HISTORIQUE TRANSACTIONNEL (HT)
L’historique des transactions décrit toutes les transactions par lesquelles un produit est passé, depuis sa fabrication. Il s’agit essentiellement d’un ensemble d’IT regroupées pour examiner l’ensemble du parcours de la chaîne d’approvisionnement d’un produit.
LA DÉCLARATION TRANSACTIONNELLE (DT)
La DT est une déclaration confirmant que le vendeur :
- Est autorisé et enregistré
- A reçu le produit d’une partie enregistrée et autorisée
- N’a pas modifié intentionnellement l’historique transactionnel
- N’a pas expédié intentionnellement des produits non admissibles, contrefaits ou suspects
- A accusé réception de la déclaration transactionnelle et des informations du vendeur précédent dans la chaîne d’approvisionnement
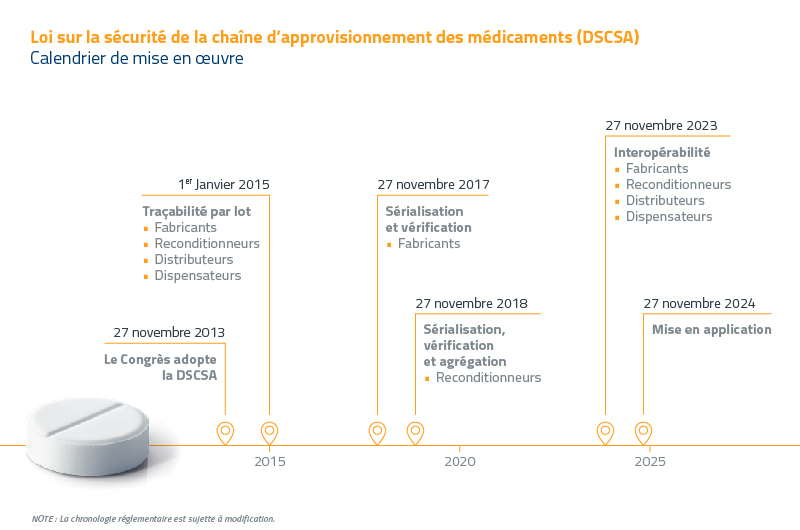
QUELLES SONT LES EXIGENCES EN MATIÈRE DE SÉRIALISATION EN VERTU DE LA DSCSA ?
Au plus tard le 27 novembre 2020, tous les acteurs clés de la chaîne d’approvisionnement pharmaceutique, y compris les reconditionneurs, les fabricants, les distributeurs et les dispensateurs, devront générer, authentifier et vérifier les numéros de série de tous les emballages circulant dans la chaîne.
En ce qui concerne les numéros de série en soi, les identificateurs numériques normalisés (SNI) doivent être générés conformément à la directive de la FDA de 2009.
Les SNI se composent du NDC (code national du médicament) à 20 caractères et du numéro de série. Outre les SNI, le numéro de lot, le code article international (GTIN) et la date d’expiration sont également requis.
En outre, la plus petite unité vendable doit être emballée avec un code-barres 2D Data Matrix avec un texte lisible par l’homme. Les caisses d’expédition nécessitent également un SNI avec un numéro séquentiel de colis (SSCC).
Quelles sont les exigences en matière d’agrégation prévues par la loi sur la sécurité de la chaîne d’approvisionnement en médicaments (DSCSA) ?
L’objectif final de la DSCSA est l’agrégation. De quoi s’agit-il ? En sérialisant à la fois les médicaments et les unités de transport (paquets, palettes et conteneurs), on obtient un système de sérialisation hiérarchique.
Dans un paquet de boîtes contenant des bouteilles, par exemple, chaque bouteille porte un numéro de série unique, tout comme la boîte. Cela forme une relation d‘agrégation entre la boîte et la bouteille.
RAISON DE L’AGRÉGATION
La sérialisation hiérarchique permet d’identifier avec précision les articles dans la chaîne d’approvisionnement et de détecter les activités suspectes. Cependant, ce n’est pas tout.
L’agrégation confère également des avantages en termes de temps et de coûts aux fabricants et aux conditionneurs de produits pharmaceutiques. Par exemple, les reconditionneurs n’ont pas besoin de passer de temps à scanner la plus petite unité vendable, et ne peuvent scanner que le parent. Cela se traduit naturellement par un gain de temps substantiel.
EXIGENCES ET CALENDRIER
Les fabricants de produits pharmaceutiques et les membres de la chaîne d’approvisionnement doivent parvenir à une agrégation complète et interopérable de suivi et de la traçabilité d’ici le 27 novembre 2023. Toutefois, il est préférable de s’y prendre à l’avance afin de disposer de suffisamment de temps pour surmonter les obstacles opérationnels et garantir une transition en douceur.
COMMENT GÉRER L’ÉCHANGE DE DONNÉES AVEC LES PARTENAIRES COMMERCIAUX ?
Une fois la DSCSA pleinement en vigueur, la conformité en matière de sérialisation affectera votre entreprise bien au-delà de la ligne de production. En réalité, vous devrez échanger des données avec différentes organisations, chacune ayant son propre système et ses propres formats de données.
Pour construire un tel système interopérable, vous aurez besoin de ce qui suit :
- Des processus et des systèmes pour inspecter le produit jusqu’au niveau de l’article
- Des systèmes permettant de traiter de manière fiable l’historique des transactions
- Gérer différents formats de fichiers tels que CSV, XML, EPCIS
- Un système de traçage interopérable
- Des protocoles d’échange de données tels qu’EDI, SFTP ou API
- Un système d’échange de la documentation 3T
Investir dans un logiciel de chaîne d’approvisionnement intelligent peut vous aider à obtenir des capacités de sérialisation, de traçabilité et d’agrégation solides et vous préparer à l’échéance finale de la DSCSA.
EXEMPTIONS DANS LE CADRE DE LA DSCSA
Tous les produits médicaux ne tombent pas sous la juridiction de la DSCSA. Voici quelques produits médicaux exemptés des exigences de la loi :
- Les distributions intra-entreprises
- La distribution d’échantillons de produits
- La distribution de médicaments en vente libre
- Les trousses médicales de proximité
- Les anesthésiques, les anticoagulants, les vasopresseurs, les solutions intraveineuses et les sympathomimétiques
- Les médicaments approuvés pour les animaux
- La distribution de gaz médicaux
- Le sang et les composants sanguins pour la transfusion
Si vous souhaitez en savoir plus et comprendre comment mettre en place les systèmes nécessaires pour répondre à ces exigences de conformité, notre expert se fera un plaisir de vous aider.